Clozapin
Mein neues Video Eine ehrliche Aufklärung über Neuroleptika ist online
In diesem Video beschreibe ich, welche Nebenwirkungen unter Neuroleptika häufig vorkommen. Ich beginne mit einem Fallbeispiel, dass zeigt, dass Neuroleptika gut gegen Psychosen wirken, aber oft aufgrund von Nebenwirkungen abgesetzt werden. Ich erkläre die Einteilung der Neuroleptika in niedrigpotente Neuroleptika und hochpotente Neuroleptika. Hochpotente Neuroleptika sollte man besser Antipsychotika nennen, da sie die psychotische Symptome gut behandeln können. Die hochpotenten Antipsychotika werden noch einmal in typische und atypische Neuroleptika unterteilt. Ich erkläre dann die vier wichtigsten dopaminergen Bahnen im Gehirn. Bei der Therapie mit Neuroleptika werden diese Bahnen in ihrer Aktivität gebremst.
Dies führt zu typischen Nebenwirkungen:
Das Mesolimbische System
- Dies ist das System, das wohl bei der Psychose am ehesten überhitzt ist. Beim Gesunden ist es für Freude, Lust und Motivation da. Wenn in diesem System Dopamin ausgeschüttet wird, dann weiß der Mensch: Hier passiert gleich etwas Wichtiges, hier lohnt es sich, aufzupassen und dranzubleiben.
- Wenn man dieses System mit Antipsychotika zu stark drosselt, ergeben sich daraus oft Lustlosigkeit und Interessenverlust.
Das Nigrostriatale System
- Dieses System ist beim Gesunden für Bewegungen zuständig.
- Eine bekannte Krankheit, bei der zu wenig Dopamin in diesem System zur Verfügung steht, ist der M. Parkinson.
- Die gleichen Beschwerden wie beim Parkinson treten auf, wenn antipsychotische Medikamente das nigrostriatale System zu stark drosseln, es entsteht ein medikamentös verursachter Parkinsonismus. Die Patienten gehen mit steifen Armen und Beinen, man sagt „wie ein Teddybär“, sie zittern, die Mimik ist reduziert und spontane Bewegungen fallen schwer.
Das Mesocortikale System
- Ist beim Gesunden für Denken, Gefühle und Motivation zuständig.
- Wird es durch Antipsychotika zu stark gedämpft, können Antriebslosigkeit und Affektverflachung entstehen. Die Patienten „kommen einfach nicht mehr aus dem Quark“ und verlieren das Interesse an allem. Nichts macht mehr richtig Spaß und daher scheint es sich für nichts mehr zu lohnen, sich aufzuraffen.
Das Tuberoinfundibuläre System
- Regelt beim Gesunden die Freisetzung des Hormons Prolactin. Das Hormon Prolactin führt zur Milchproduktion in den Brustdrüsen. Dies ist bei Frauen in der Stillzeit ja auch sinnvoll.
- Dopamin ist das „Prolactin inhibitin factor“ eine Dopaminblockade durch Antipsychotika führt also zu einer Überproduktion von Prolactin, einer Hyperprolactinämie.
- Wenn zu viel Prolactin im Blut ist kommt es bei Frauen und Männern zu einem Milchfluß. Es fließt also sowohl bei Frauen als auch bei Männern aus den bei Männern ja auch angelegten Brustdrüsen Milch. Darüber hinaus kann es durch einen zu hohen Prolactinspiegel zu sexuellen Funktionsstörungen kommen.
Dann gehe ich kurz auf einige spezifische Nebenwirkungen bestimmter Neuroleptika ein, wie z.B. QTc-Zeit-Verlängerungen, das metabolische Syndrom oder die Agranulozytose. Schließlich nenne ich einige Vorgehensweisen, die helfen können, Nebenwirkungen zu verhindern und spreche darüber, was man tun kann, wenn dennoch Nebenwirkungen aufgetreten sind.
Quellen
https://commons.wikimedia.org/wiki/File:Dopaminergic_pathways.svg
Wem meine Grafik gefällt, der darf sie gerne weiterverwenden:

Vereinfachte Nebenwirkungsprofile ausgewählter Antipsychotika

Ich habe mich – aus Gründen – hier mal an einer Grafik versucht, die das Nebenwirkungsprofil ausgewählter Antipsychotika vereinfachend aber übersichtlich darstellt. Die Kunst bei dieser Grafik läge darin, zu vermitteln, wo der Hase bei jedem einzelnen Medikament im Pfeffer liegt, wohl wissend, dass dies alles eine Vereinfachung ist.
Wie sieht die Grafik für euch aus? Kann man damit was anfangen? Ist das ganze Konzept zu vereinfachend? Muss ein bestimmtes Medikament in eine Richtung verrückt werden?
Schreibt mir eure Ideen dazu gerne in die Kommentare! #followerpower
Wie rechne ich die Dosis eines Neuroleptikums auf ein anderes um?
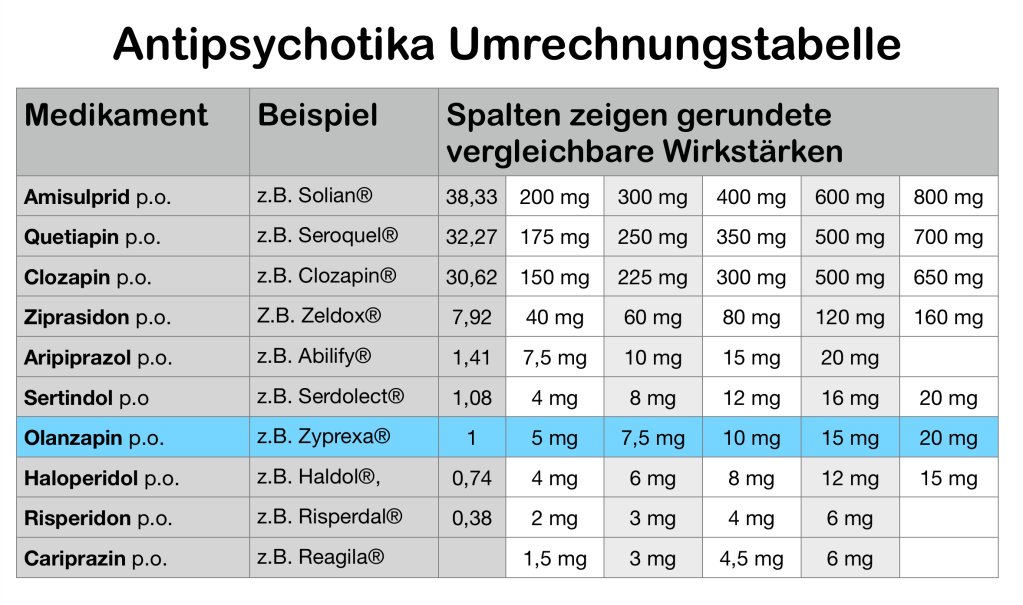
Wenn man ein Medikament aus einer bestimmten Gruppe auf ein anderes Medikament aus derselben Gruppe umstellen möchte, dann ist es ganz hilfreich, eine Vorstellung davon zu haben, welche Dosierungen sich in etwa entsprechen. Natürlich kann man die Dosierungen nicht einfach umrechnen, denn jede Substanz hat doch etwas andere Hauptwirkungen und oft erheblich unterschiedliche Nebenwirkungen. Dennoch ist es hilfreich, einen Anhaltspunkt zu haben, in welcher Größenordnung sich die neue Dosis so bewegt.
Es gibt verschiedene Arten, an so eine Umrechnungstabelle zu kommen. Die klassische Variante ist die von Davis 1974 angewendete: Man nimmt sich alle verfügbaren Studien zu Medikamenten einer Gruppe, in der die Studienärzte nicht wussten, welches Medikament sie gaben, aber die Dosis nach der klinischen Wirkstärke anpassen konnten. Dann nimmt man den Mittelwert der jeweils gegebenen Dosierungen und geht davon aus, dass diese Mittelwerte vergleichbar sind. In einer ausgezeichneten Arbeit hat Leucht dieses Vorgehen 2015 für atypische Antipsychotika durchgeführt1. Das PDF der Studie ist kostenlos hier zu laden.
Cariprazin wurde in dieser Studie nicht untersucht. Die Äquivalenzwerte für Cariprazin habe ich daher aus meiner eigenen klinischen Erfahrung geschätzt und mich an dieser Studie2 angelehnt.
Ich habe auf diesem Blog bereits meine eigene Umrechnungstabelle für Opiate und meine eigene Umrechnungstabelle für Antidepressiva veröffentlicht. Das Bild oben zeigt die Tabelle, die sich aus der Studie von Leucht für die Gruppe der Antipsychotika ergeben. Ich habe deutsche Handelsnamen eingesetzt, die resultierenden Dosierungen auf für die nächste für dieses Präparat übliche Dosis gerundet und diejenigen Tabellenfelder leer gelassen, die Dosierungen enthalten hätten, die für dieses Präparat in Deutschland nicht zugelassen sind.
Wer sich ein eigenes Bild über meine Rundungen und Vereinfachungen machen möchte, der findet die Tabelle mit den präzise berechneten Werten, die ich als Ausgangswerte für die Tabelle oben genommen habe, hier:
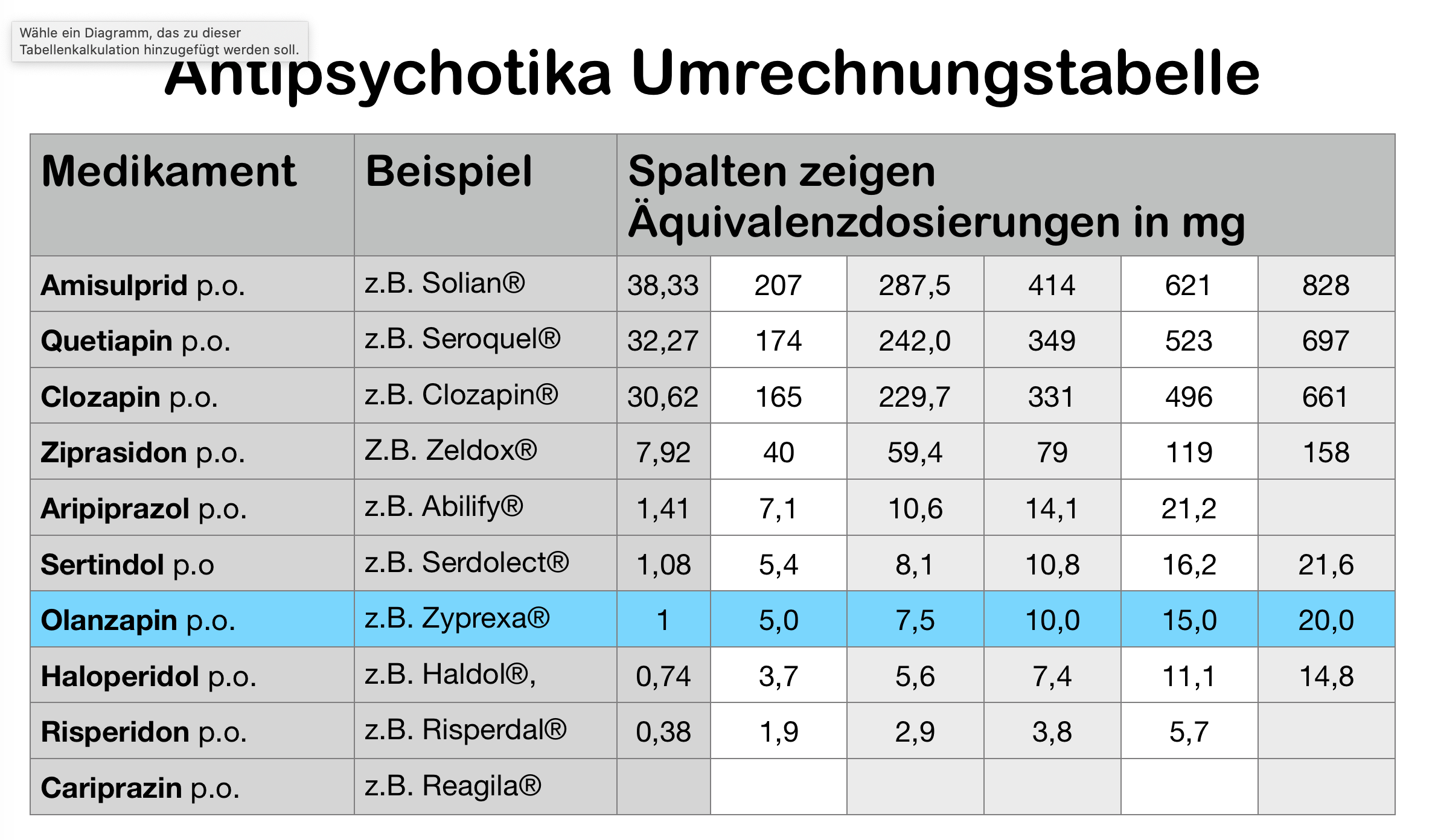
Meiner persönlichen Einschätzung nach ist die Tabelle oben realistisch und gut geeignet, einen Anhaltspunkt dafür zu geben, welche Dosis eines Antipsychotikums welcher Dosis eines anderen Antipsychotikums entspricht.
Disclaimer
Auch zu dieser Tabelle möchte ich sagen, dass die hier angegebenen Dosierungen nicht ungeprüft übernommen werden dürfen. Die Verschreibung obliegt der Verantwortung des verschreibenden Arztes, der anhand der Fachinformationen, der individuellen Situation des Patienten und aller anderen relevanten Faktoren eine Wahl treffen muss.
Copyright
Dieser Beitrag ist ein Auszug beziehungsweise eine auszugsweise Vorabveröffentlichung des Werks „Psychopharmakotherapie griffbereit“ von Dr. Jan Dreher, © Georg Thieme Verlag KG. Die ausschließlichen Nutzungsrechte liegen beim Verlag. Bitte wenden Sie sich an permissions@thieme.de, sofern Sie den Beitrag weiterverwenden möchten.
- 1 Leucht S, Samara M, Heres S, Patel MX, Furukawa T, Cipriani A, Geddes J, Davis JM. Dose Equivalents for Second-Generation Antipsychotic Drugs: The Classical Mean Dose Method. Schizophr Bull 2015; 41: 1397–1402 Im Internet: https://academic.oup.com/schizophreniabulletin/article/41/6/1397/2526028 ↩︎
- 1 Németh G, Laszlovszky I, Czobor P, Szalai E, Szatmári B, Harsányi J, Barabássy Á, Debelle M, Durgam S, Bitter I, Marder S, Fleischhacker WW. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017; 389: 1103–1113 Im Internet: https://linkinghub.elsevier.com/retrieve/pii/S0140673617300600 ↩︎
Erratum: Die Grafik des Rezeptorbindungsprofils von Clozapin hatte im dritten Segment von oben eine falsche Bezeichnung
In meinem post heute morgen hatte ich sowohl in der Einzeldarstellung des Rezeptorbindungsprofils von Clozapin als auch in der Übersicht der Neuroleptika bei der Substanz Clozapin im dritten Block von oben einen Fehler. Der dritte und der vierte Block von oben waren mit H1 beschriftet, richtig ist, dass der obere dieser beiden Teile M1 heißen muss. Mir war das nicht aufgefallen, und auch im Buch hat sich dieser (kleine) Fehler eingeschlichen.
Dankenswerterweise ist es dem Leser Daniel aufgefallen, und ich habe die Grafiken im letzten post jetzt korrigiert und ausgetauscht. In die nächste Überarbeitung des Buches geht diese Korrektur natürlich auch ein.
Das ist ja einer der großen Vorteile dieses Blogs, dass viele Augen auf die Posts schauen und Fehler damit eine viel kleinere Chance haben, durchzukommen.
Ganz herzlichen Dank noch mal an Daniel!
Hier folgen die korrigierten Grafiken:



Psychopharmakologisches Fallbeispiel: Umstellung von Clozapin auf ein anderes Medikament
Anamnese
Der 32 jährige Herr Schmitz leidet seit mehr als 10 Jahren an einer chronischen Schizophrenie mit zunehmendem Residuum. Auch in guten Zeiten hört er manchmal bedrohliche Stimmen und wähnt, verfolgt zu werden. Frühere Behandlungsversuche mit Risperidon, Haloperidol und Amisulprid hatten wenig Verbesserung gebracht. Seit zwei Jahren nimmt er nun Clozapin ein, aktuell in einer Dosis von 400 mg pro Tag, worunter der Blutspiegel im therapeutischen Bereich liegt. Unter dieser Medikation ist er recht stabil, hört nur noch sehr selten Stimmen, oft tagelang gar nicht und spricht kaum über Wahnsymptome. Er ist seit einigen Monaten in einer betreuten Werkstatt tätig und kommt hier recht gut zurecht.
Aktuelles Problem
Bei Herrn Schmitz ist es seit drei Tagen zu einer akuten Entzündung der Ohrspeicheldrüse (Parotitis) gekommen, dies kann eine Nebenwirkung von Clozapin sein. Die Entzündung ist sehr schmerzhaft und Herr Schmitz lehnt es ab, weiterhin Clozapin zu nehmen. Er ist aber einverstanden, auf ein anderes Antipsychotikum umgestellt zu werden. Welches würdest Du ihm empfehlen?
Was würdest Du geben?
Halt an dieser Stelle einmal inne und überleg dir: Welches Antipsychotikum würdest Du ihm empfehlen? Warum hast Du Dich genau für diesen Vorschlag entschieden?
Gibt es bei dieser Wahl eine rationale Antwort?
Clozapin wurde aufgrund einer möglichen Nebenwirkung aufgegeben, nicht aufgrund mangelnder Wirksamkeit. Daher sollten wir als nächstes dasjenige Antipsychotikum aussuchen, dass Clozapin in Bezug auf sein Rezeptorbindungsprofil am ähnlichsten ist, hoffentlich, ohne die spezielle Nebenwirkung einer Parotitis zu verursachen.
Welches andere Antipsychotikum hat ein ähnliches Rezeptorbindungsprofil wie Clozapin?
Schauen wir und die Rezeptorbindungsprofile der wichtigsten Antipsychotika daher einmal genauer an:  Warum Clozapin auch bei sonst therapieresistenten Patienten manchmal besonders gut wirkt, ist letztlich nicht geklärt. Man vermutet, dass die relativ starke D3 und D4-Blockade bei relativ schwacher D2-Blockade eine Rolle spielen kann. Die antiserotonerge 5HT2A-Blockade könnte über eine hieraus resultierende erhöhte Dopaminausschüttung in bestimmten Hirnarealen für die gering bis gar nicht vorhandenen EPMS-Symptome verantwortlich sein. Man kann nun lange grübeln, welches andere Antipsychotikum dem Clozapin am ehesten ähnelt. Ich würde in Übereinstimmung mit vielen Psychopharmakologen sagen, dass Olanzapin ebenfalls eine relativ ausgeprägte D3/D4-Blockade macht, allerdings auch eine stärkere D2-Blockade. Wie Clozapin blockiert es den 5HT2A-Rezeptor, und es hat ebenfalls eine recht ausgeprägte sedierende Eigenschaft, vermittelt über die Histamin- und Muskarin-Rezeptorblockaden.
Warum Clozapin auch bei sonst therapieresistenten Patienten manchmal besonders gut wirkt, ist letztlich nicht geklärt. Man vermutet, dass die relativ starke D3 und D4-Blockade bei relativ schwacher D2-Blockade eine Rolle spielen kann. Die antiserotonerge 5HT2A-Blockade könnte über eine hieraus resultierende erhöhte Dopaminausschüttung in bestimmten Hirnarealen für die gering bis gar nicht vorhandenen EPMS-Symptome verantwortlich sein. Man kann nun lange grübeln, welches andere Antipsychotikum dem Clozapin am ehesten ähnelt. Ich würde in Übereinstimmung mit vielen Psychopharmakologen sagen, dass Olanzapin ebenfalls eine relativ ausgeprägte D3/D4-Blockade macht, allerdings auch eine stärkere D2-Blockade. Wie Clozapin blockiert es den 5HT2A-Rezeptor, und es hat ebenfalls eine recht ausgeprägte sedierende Eigenschaft, vermittelt über die Histamin- und Muskarin-Rezeptorblockaden. 
Wie ist die Wahrscheinlichkeit, dass auch Olanzapin eine Parotitis verursacht?
Die Vergrößerung der Ohrspeicheldrüse wird in der Fachinfo von Clozapin als „Sehr seltene“ (\<1/10.000) Nebenwirkung genannt. Kennt man den Mechanismus, der zur Parotitis führen kann? Man geht davon aus, dass der erhöhte Speichelfluß unter Clozapin auf eine reduzierte Schluckfähigkeit zurück zu führen ist; die durch die Blockade des Acetylcholin-M1-Rezeptors verursachte Mundtrockenheit wiegt diese Schluckstörung nicht auf. Wie dies aber die seltene Nebenwirkung einer Parotitis begünstigt, ist nicht klar. Wie sieht’s bei Olanzapin mit Parotitiden aus? In der Fachinfo von Olanzapin erscheint diese Nebenwirkung nicht. Man darf also hoffen, dass es unter Olanzapin nicht zu einer Parotitis kommt.
Mein Vorschlag: Umstellung auf Olanzapin
Daher würde ich in dieser Situation am ehesten vorschlagen, Clozapin auf Olanzapin umzustellen. Es hat eine relativ große Ähnlichkeit zu Clozapin, verursacht aber laut Fachinfo keine Parotitiden.
Clozapin-Absetzsyndrom
Wenn man Clozapin nach längerer Gabe, wie im hier beschriebenen Fall, absetzt, kann es zu einem schweren Clozapin-Absetzsyndrom kommen. Dies kann sich als Absetzpsychose, Delir oder Unruhezustand zeigen. Ursächlich hierfür ist am ehesten der plötzliche Wegfall der anticholinergen Komponente. Daher sollte man ein anderes anticholinerg wirksames Medikament wie beispielsweise Promethazin übergangsweise geben. Die sofortige Eindosierung eines bezüglich des Rezeptorbindungsprofils ähnlichen Medikamentes kann der Absetzpsychose entgegenwirken.
Was hättest Du getan?
Schreib Dein Vorgehen in die Kommentare!
Senken auch E-Zigaretten den Clozapin-Blutspiegel?
Erfreulicherweise steigen immer mehr Patienten von Zigaretten auf E-Zigaretten um. Das reduziert die Gefahr von Herz-Kreislauf-Erkrankungen und Krebserkrankungen stark. Aber was ist mit möglichen Auswirkungen auf die Blutspiegel bestimmter Medikamente wie Clozapin und Olanzapin? Der Anteil der psychiatrischen Patientinnen und Patienten, die rauchen, ist auffallend hoch. Das mag vielerlei Gründe haben, etwa, dass viele psychiatrische Erkrankungen mit einem erhöhten Maß an Nervosität einhergehen, und Rauchen reduziert für manche Patienten die Nervosität. Ein anderer Grund, den Psychopharmakologen immer gerne anführen, ist, dass Rauchen den Blutspiegel bestimmter Medikamente wesentlich reduzieren kann, und so Nebenwirkungen abnehmen. Und natürlich auch die Wirksamkeit. Patientinnen, die wirklich viel rauchen, also in der Größenordnung von einer Packung am Tag, können bei bestimmten Medikamenten den Blutspiegel um bis zu ein Drittel und in Einzelfällen um bis zur Hälfte senken.
Wie funktioniert das?
Zigarettenrauch enthält polyzyklische aromatische Kohlenwasserstoffe (PAK). Einige PAKs verursachen Krebs, daher ist es ohnehin sinnvoll, nach Wegen zu suchen, diese zu vermeiden. Eine zweite Wirkung der PAKs ist die Induktion (Ankurbelung der Produktion) des Cytochrom-P450-Isoenzyms CYP1A2. Je mehr P450 CYP1A2 man im Körper hat, desto schneller werden Medikamente abgebaut, die eben über CYP1A2 abgebaut werden, und dazu gehören Clozapin und Olanzapin. Das ist der Mechanismus, der dazu führt, dass starke Tabakraucher bei gleicher Clozapin-Dosis niedrigere Clozapin-Blutspiegel aufweisen.
Und wie ist das bei E-Zigaretten?
Im Rauch von E-Zigaretten sind kaum PAKs enthalten. Daher verursachen sie vermutlich keinen Krebs und sie induzieren auch kaum oder gar nicht Enzyme wie das P450 CYP1A2. Und also reduzieren sie auch nicht den Blutspiegel von Clozapin oder Olanzapin. Das Nikotin, das natürlich auch im Rauch der E-Zigaretten enthalten ist (wobei es auch Liquids ohne Nikotin gibt), führt nicht zu einer Induktion dieses Enzyms.
Preisfrage: Was geschieht, wenn ein Patient, der Clozapin einnimmt, von normalen Zigaretten auf E-Zigaretten umsteigt?
Genau. Umstieg auf E-Zigaretten -> Keine Enzyminduktion mehr -> Kein beschleunigter Abbau des Clozapins mehr -> Anstieg des Clozapinblutspiegels trotz gleicher Dosis.
Aber aber! Jetzt übertreibst Du aber. Das sind doch rein theoretische Überlegungen, in der Praxis passiert so was doch nicht. Ihr Psychopharmakologen spielt euch mit euren Wechselwirkungen immer nur auf, oder!?
Ein Fallbericht über einen toxischen Clozapin-Plasmaspiegel nach Zigarettenabstinenz findet ihr hier.
Die Rezeptorbindungsprofile der Neuroleptika
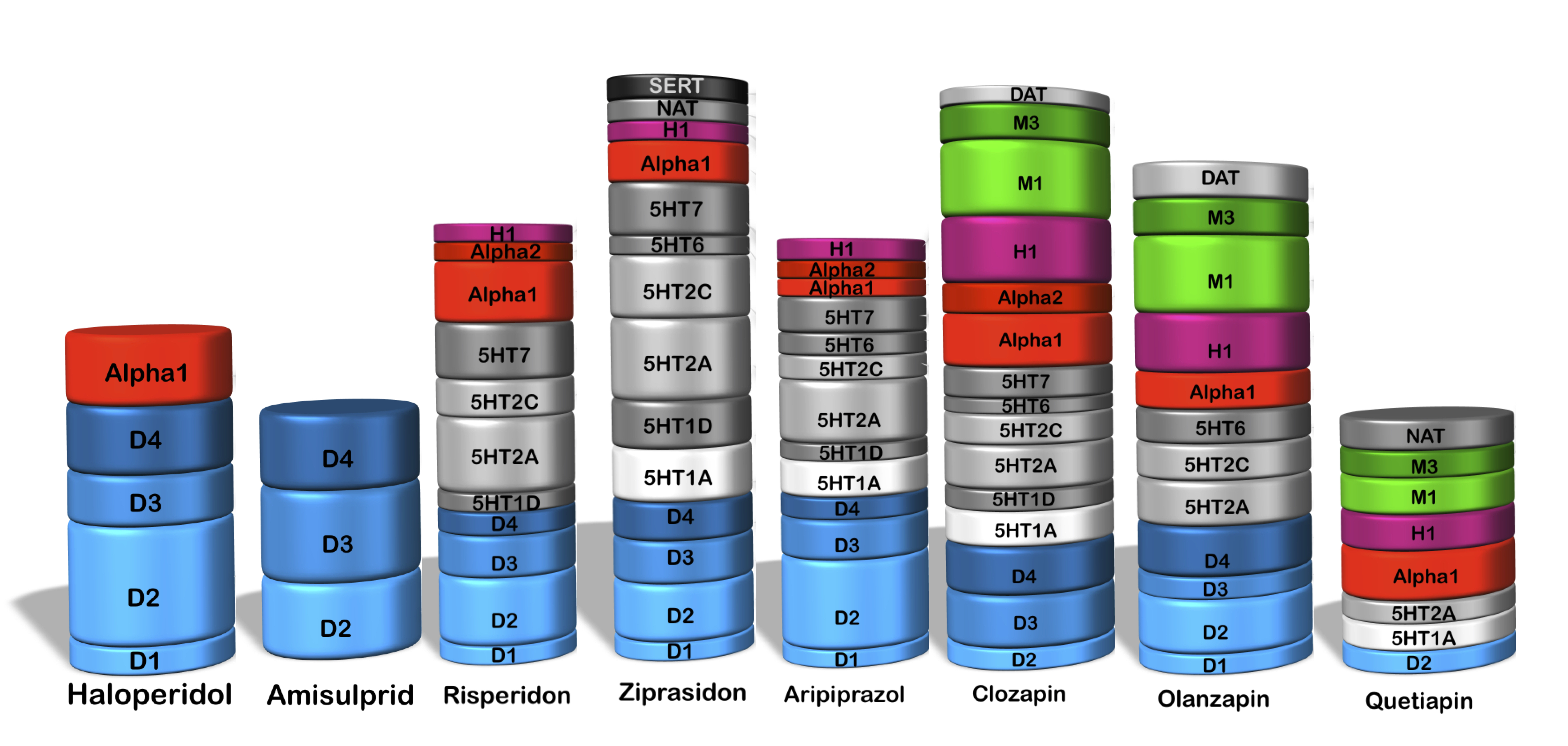
Rezeptorbindungsprofile sind so etwa wie das „Persönlichkeitsprofil“ der Medikamente. Sie bestimmen im Wesentlichen die Wirkungen sowie die unerwünschten Wirkungen jedes einzelnen Medikamentes.
Das Rezeptorbindungsprofil eines Neuroleptikums sagt aus, wie stark dieses Medikament an welche Rezeptoren bindet; welche Affinität es zu den jeweiligen Rezeptortypen hat. Daraus kann man sich die pharmakologischen und klinischen Eigenschaften des Medikamentes im Wesentlichen erschließen. Die folgende Tabelle zeigt wichtige rezeptorblockadebedingte Wirkungen:

(Modifiziert nach Hiemke und Stahl, 2013)
Es gibt darüber hinaus noch vereinzelt weitere Nebenwirkungen, die sich nicht aus der Blockade eines Rezeptors erklären. Ein Beispiel hierfür ist die blutbildschädigende Wirkung des Clozapins, die eine allergische Reaktion ist.
Wenn man sich selbst ein Bild davon machen möchte, was man von einem Medikament zu erwarten hat, sind die Rezeptorbindungsprofile sicherlich der beste Einstieg. Die Übersichtsgrafik zeigt die häufigsten Neuroleptika sowie zum Vergleich das alte Chlorpromazin. Die Grafiken sind so zu lesen, dass die „Dicke“ einer Scheibe anzeigt, wie stark das Medikament den entsprechenden Rezeptor blockiert. Bewirkt ein Medikament an einem bestimmten Rezeptor keine Blockade, ist keine entsprechende Scheibe eingezeichnet. Bei den einzelnen Substanzen sind die typischen Wirkungen und Nebenwirkungen der jeweiligen Rezeptorblockade als Textanmerkung gleich mit eingezeichnet.
Die blauen Blöcke stehen für die Dopaminrezeptoren D1-D4. Die grauen Blöcke stehen für die Serotoninrezeptoren 5HT1-7, wobei der erste Block für einen 5HT1A-Partialagonismus steht. Alpha1 und Alpha2 repräsentieren die Alpha 1 und Alpha 2-Adrenorezeptoren. Es folgen der H1=Histamin-H1 und die M1/M3=muskarinischen Acetylcholinrezeptoren. DAT ist der Dopamin-Transporter, NAT der Noradrenalin-Transporter und SERT der Serotonin-Transporter.
Vorstellung der wichtigsten Neuroleptika mit ihrem jeweiligen Rezeptorbindungsprofil
Haloperidol

Haloperidol ist der Klassiker eines typischen Neuroleptikums. Es blockiert stark die Dopamin-D2-Rezeptoren, was zu einer sicheren antipsychotischen Wirkung, aber in höheren Dosierungen auch zu EPMS und Hyperprolaktinämie führt. Ein Teil der vegetativen Nebenwirkungen und ein Teil der Sedierung sind auf die Blockade der Alpha-1-Adrenozeptoren zurückzuführen.
Amisulprid

Amisulprid ist ein lupenreiner Dopamin-Rezeptor-Antagonist. Das erklärt seine gute antipsychotische Wirkung. In höheren Dosierungen verursacht es EPMS und Hyperprolaktinämie. Es hat praktisch keine sedierenden oder anderen vegetativen Nebenwirkungen, da es praktisch keine anderen Rezeptoren blockiert.
Risperidon

Risperidon blockiert zum einen wie ein typisches Neuroleptikum in relevantem Ausmaß die Dopamin-D2-Rezeptoren, und zum anderen wie viele atypische Neuroleptika den Serotonin-5HT2A-Rezeptor. Es verursacht nur in geringem Maße Gewichtszunahme und Müdigkeit, entsprechend seiner nur geringen, aber vorhandenen Aktivität am Histamin H1-Rezeptor.
Ziprasidon

Ziprasidon entspricht ganz dem Profil eines atypischen Neuroleptikums. Es blockiert zwar auch den D2-Rezeptor, hat seinen Schwerpunkt aber eher auf 5HT2A. Interessant ist die Noradrenalin- und Serotonin-Wiederaufnahmehemmung, die eine milde antidepressive und angstlösende Wirkung plausibel macht.
Aripiprazol

Im Falle des Aripiprazols muss man wissen, das die Affinität dieses Medikamentes zum Dopamin-D2-Rezeptor nicht nur antagonistische, sondern auch partiell agonistische Wirkungen hat. Dies relativiert einige der D2-bezogenen Nebenwirkungen, so verursacht Aripiprazol tatsächlich weniger EPMS, als dem Ausmaß der D2-Affinität in diesem Schaubild entsprechen würde. Man erhofft sich vom partiellen Dopamin-D2-Agonismus auch eine positive Wirkung auf Antrieb, Stimmung und kognitive Fähigkeiten.
Clozapin

Clozapin hat ein ganz spezielles Rezeptorbindungsprofil. Der hohe Anteil der Dopamin-D4-Blockade wird mit seiner guten antipsychotischen Wirkung bei wenig EPMS in Verbindung gebracht. Und die Affinität von Clozapin zu den Dopamin-D2-Rezeptoren ist ja vergleichsweise niedrig. Betrachtet man jedoch den oberen Teil der Grafik, weiß man, warum Clozapin so ausgeprägte Nebenwirkungen verursacht. Insbesondere Müdigkeit und Gewichtszunahme (H1) wirken sich klinisch stark aus. Der erhöhte Speichelfluß unter Clozapin ist auf eine reduzierte Schluckfähigkeit zurück zu führen; die durch die Blockade des Acetylcholin-M1-Rezeptors verursachte Mundtrockenheit wiegt diese Schluckstörung nicht auf.
Olanzapin

Olanzapin hat aus der Sicht des Rezeptorbindungsprofils viel Ähnlichkeit mit Clozapin. Interessant ist auch hier, dass Dopamin-D4-Rezeptoren fast so stark blockiert werden wie Dopamin-D2-Rezeptoren, was für eine gute antipsychotische Wirkung bei wenig EPMS spricht. Allerdings blockiert Olanzapin ebenfall stark den Histamin-H1-Rezeptor, was die Sedierung und Gewichtszunahme erklärt.
Quetiapin

Der Blick auf das Rezeptorbindungsprofil von Quetiapin zeigt ein solides mittelpotentes Neuroleptikum mit einer recht ausgeprägten Sedierung (Alpha1, H1, M1, M3) und einer milden antipsychotischen Wirkung (D2, 5HT2A).
Copyright
Ihr dürft diese Darstellungen gerne unter Nennung der Quelle http://www.psychiatrietogo.de weiterverwenden und auch weiter verbessern. Dann schickt mir doch gerne einen Link auf eure Version. Ich bin gespannt auf eure Kommentare!
Meine neue Darstellung der Rezeptorbindungsprofile

Ich habe auf dem diesjährigen DGPPN-Kongress zum wiederholten Mal den Workshop „Psychopharmakologie-Update“ von Francesca Regen, Arnim Quante und Eric Hahn besucht. Die drei berichten sehr kompetent und zugleich sehr verständlich von den nennenswerten Neuerungen im letzten Jahr.
Noch eine Variante: Das klassische Kreisdiagramm

Üblicherweise stellt man die Rezeptorbindungsprofile so dar, wie in dem oben wiedergegebenen Kreisdiagramm zu Risperidon. Diese Abbildung ist aus meinem Buch Psychopharmakotherapie griffbereit, Dritte Auflage, entnommen. Die Darstellung ist übersichtlich, aber interpretationsbedürftig.
Wie interpretiere ich das Rezeptorprofil eines Neuroleptikums?
Ich hatte in diesem post schon einmal die wesentlichen Wirkungen der Blockade (oder partiellen Aktivierung) bestimmter Rezeptoren dargestellt.
Die Darstellung á la Hiemke gefällt mir besonders gut, da ich mir das Medikament in dieser Darstellung wie einen Schlüssel vorstelle. Die Balken darauf entsprechen den Zacken des Bartes des Schlüssels. Man hat ja immer die Analogie im Kopf, dass sich ein Wirkstoff zum Rezeptor wie ein Schlüssel zum Schloss verhält. Das stimmt auch für die primären Wirkstoffe wie Dopamin oder Serotonin. Wobei man im Kopf behalten muss, dass diese Wirkstoffe die Rezeptoren aktivieren, die Medikamente die Rezeptoren aber in der Regel blockieren. Ausnahmen stellen Medikamente wie Aripiprazol dar, die überwiegend Rezeptoren blockieren, einige wenige Rezeptoren aber partiell aktivieren.
Neuer Ansatz: Rezeptoraktivität und deren Wirkungen in einem Schaubild
Nun habe ich mir überlegt, dass es etwas mühsam ist, die Rezeptoraktivität in einem Diagramm darzustellen und die Wirkung, also die erwünschten Wirkungen und die unerwünschten Wirkungen dieser Aktivität am Rezeptor, in einer zweiten Tabelle nachzulesen. Daher habe ich in meiner neuen Darstellung die jeweilige Rezeptoraktivität mit der erklärenden Tabelle überlagert. Die Darstellungen sind so zu lesen, dass die Länge des farbigen Balkens die Aktivität des jeweiligen Medikamentes an diesem Rezeptor wiedergibt. Wenn ein Medikament einen bestimmten Rezeptor gar nicht blockiert, dann ist der Text daneben entsprechend ausgegraut.
Vorstellung der wichtigsten Neuroleptika mit ihrem jeweiligen Rezeptorbindungsprofil
Haloperidol

Haloperidol ist der Klassiker eines typischen Neuroleptikums. Es blockiert stark die Dopamin-D2-Rezeptoren, was zu einer sicheren antipsychotischen Wirkung, aber in höheren Dosierungen auch zu EPMS und Hyperprolaktinämie führt. Ein Teil der vegetativen Nebenwirkungen und ein Teil der Sedierung sind auf die Blockade der Alpha-1-Adrenozeptoren zurückzuführen.
Amisulprid

Amisulprid ist ein lupenreiner Dopamin—Rezeptor-Antagonist. Das erklärt seine gute antipsychotische Wirkung. In höheren Dosierungen verursacht es EPMS und Hyperprolaktinämie. Es hat praktisch keine sedierenden oder anderen vegetativen Nebenwirkungen, was der Abwesenheit von Rezeptorblockaden anderer Rezeptoren entspricht.
Risperidon

Risperidon blockiert zum einen wie ein typisches Neuroleptikum in relevantem Ausmaß die Dopamin-D2-Rezeptoren, und blockiert zum anderen wie viele atypische Neuroleptika den Serotonin-5HT2A-Rezeptor. Es verursacht nur in geringem Maße Gewichtszunahme und Müdigkeit, entsprechend seiner nur geringen, aber vorhandenen Aktivität am Histamin H1-Rezeptor.
Ziprasidon

Ziprasidon entspricht ganz dem Profil eines atypischen Neuroleptikums. Es blockiert zwar auch den D2-Rezeptor, hat seinen Schwerpunkt aber eher auf 5HT2A. Interessant ist die Noradrenalin- und Serotonin-Wiederaufnahmehemmung, die eine milde antidepressive und angstlösende Wirkung plausibel macht.
Aripiprazol

Diese Darstellung ist für Aripiprazol eigentlich ungeeignet, da Aripiprazol am Dopamin-D2-Rezeptor sowohl antagonistische Wirkungen hat (das ist auch dargestellt), als auch partiell agonistisch am Dopamin-D2-Rezeptor wirkt (das ist hier nicht dargestellt). Diese partialagonistische Wirkung an D2 relativiert einige der Nebenwirkungen und natürlich auch einige der Wirkungen des Medikamentes an diesem Rezeptor. Und das auch noch dosisabhängig. OK, die Darstellung ist natürlich eine Vereinfachung. Im übrigen zeigt sich das Profil eines atypischen Neuroleptikums mit milden Nebenwirkungen.
Chlorpromazin

Chlorpromazin wird in Deutschland praktisch nicht mehr verordnet. Es ist ein mittelpotentes Neuroleptikum mit eher sedierenden Eigenschaften. Ein Nischendasein führt es noch in der Behandlung des chronischen Schluckaufs…
Clozapin

Clozapin ist zwar ein Oldtimer, hat aber ein ganz spezielles Rezeptorbindungsprofil. Der hohe Anteil der Dopamin-D4-Blockade wird allgemein mit seiner guten antipsychotischen Wirkung bei wenig EPMS in Verbindung gebracht. Und D2-Rezeptoren läßt Clozapin ja ziemlich in Ruhe. Sieht man sich aber den unteren Teil der Grafik an, weiß man auch, warum es so ausgeprägte Nebenwirkungen verursacht. Insbesondere Müdigkeit und Gewichtszunahme (H1) wirken sich klinisch stark aus. Der erhöhte Speichelfluß unter Clozapin ist ursächlich auf eine reduzierte Schluckfähigkeit zurück zu führen. Die durch die Blockade des Acetylcholin-M1-Rezeptors verursachte Mundtrockenheit wiegt die Schluckstörung nicht auf.
Olanzapin

Olanzapin hat aus der Sicht des Rezeptorbindungsprofils viel Ähnlichkeit mit Clozapin. Interessant ist auch hier, dass D4-Rezeptoren fast so stark blockiert werden wie D2-Rezeptoren, was für eine gute antipsychotische Wirkung bei wenig EPMS spricht. Allerdings blockiert Olanzapin eben auch stark den Histamin-H1-Rezeptor, was die Sedierung und Gewichtszunahme erklärt.
Quetiapin

Quetiapin wurde ja lange als neuroleptisches Wundermittel vermarktet. Der Blick auf das Rezeptorbindungsprofil zeigt ein solides mittelpotentes Neuroleptikum mit einer recht ausgeprägten Sedierung (Alpha1, H1, M1, M3) und einer milden antipsychotischen Wirkung (D2, 5HT2A).
Bitte um Feedback
Ich selbst bin ein großer Freund des Studiums des Rezeptorbindungsverhaltens der Medikamente. In meinen Augen entsprechen die neuroleptische Wirkstärke, das typische / atypische Wirkprofil und auch die Nebenwirkungen, die man in der Praxis beobachtet, ziemlich genau diesen Profilen.
Nun bitte ich euch um euer Feedback!
- Wie verständlich ist diese Art der Darstellung?
- Gibt es falsche oder unklare Beschreibungen im Text der Tabelle?
- Was könnte man verbessern, um die Darstellung noch eingängiger zu gestalten?
Ihr dürft die Darstellung gerne unter Nennung der Quelle weiterverwenden und auch weiter verbessern. Dann schickt mir doch gerne einen Link auf eure Darstellung. Ich bin gespannt auf eure Kommentare!
Das Metabolische Syndrom: Bauchumfang und Neuroleptika
Schwangere dürfen schon mal einen größeren Bauchumfang haben. Bei nichtschwangeren Frauen und bei Männern, die einen Bauchumfang von mehr als 94 cm haben, müsste man an das Metabolische Syndrom denken. Es entwickelt sich oft in Folge eines ungesunden Lebensstils (wenig Bewegung, zu viel Essen). Für die Psychiatrie spielt es eine besonders große Rolle, da es durch Neuroleptika ausgelöst oder verstärkt werden kann.
Das metabolische Syndrom (manchmal auch als tödliches Quartett bezeichnet) wird heute als der entscheidende Risikofaktor für koronare Herzkrankheiten angesehen. Es ist charakterisiert durch diese vier Faktoren:
- abdominelle Fettleibigkeit
- Bluthochdruck
- veränderte Blutfettwerte und
- Insulinresistenz.
Bauchumfang als Leitkriterium
Eine große Rolle für die Definition des metabolischen Syndroms spielt der erhöhte Bauchumfang. Denn für das kardiovaskuläre Risiko ist bei Vorliegen eines Übergewichts das Fettverteilungsmuster von Bedeutung: Besonders nachteilig wirken sich hier Fettdepots im Bauchraum und an den inneren Organen aus. Dieses innere Bauchfett ist sehr stoffwechselaktiv. Es beeinflusst den Fett- und Kohlenhydratstoffwechsel, so dass Fettstoffwechselstörungen und Diabetes die Folge sein können.
Voraussetzung für das Vorhandensein des metabolischen Syndroms ist das Vorliegen einer bauchbetonten (sogenannten zentralen) Adipositas: Bei Männern Bauchumfang ≥ 94 cm, bei Frauen ≥ 80 cm (Menschen europäischer Herkunft, für Asiaten gelten andere Werte).
Kommen zu diesem Leitfaktor noch mindestens zwei der Risikofaktoren
- Nüchternblutzuckerwerte von > 100 mg/dl oder diagnostizierter Diabetes mellitus,
- erhöhte Triglyceride > 150 mg/dl oder bereits eingeleitete Therapie zur Senkung der Triglyzeride,
- niedriges HDL-Cholesterin: < 40 mg/dl bei Männern und < 50 mg/dl bei Frauen oder bereits eingeleitete Therapie zur Erhöhung des HDL
- Bluthochdruck (ab > 130 mmHg systolisch und > 85 mmHg diastolisch) oder bereits behandelte Hypertonie
hinzu, besteht eine deutlich höhere Gefahr, im Laufe des Lebens eine Herz-Kreislauf-Erkrankung zu erleiden.
Einige Neuroleptika können bei einem Teil der Patienten eine deutliche Gewichtssteigerung verursachen. Besonders ausgeprägt ist dies bei Clozapin (Leponex), das manchmal Gewichtssteigerungen von bis zu 25 Kilogramm verursachen kann. Aber auch Olanzapin (Zyprexa) und seltener auch anderen Atypika können bei etwa einem Fünftel bis einem Zehntel der Patienten eine Gewichtszunahme von mehreren Kilogramm verursachen. Auch Antidepressiva wie Mirtazapin oder die Gruppe der trizyklischen Antidepressiva können eine Gewichtszunahme verursachen. Diese liegt meist in der Größenordnung von 3-5 Kilogramm, kann aber im Einzelfall auch ausgeprägter sein. Entweder in Folge der Gewichtszunahme oder als direkte Folge der Medikation kann es auch zur Entwicklung der anderen Risikofaktoren kommen: Entwicklung eines Diabetes, Erhöhung der Blutfette, Entwicklung einer arteriellen Hypertonie.
Über die Gefahr des Auftretens oder der Verstärkung eines metabolischen Syndromes sollte man die Patienten vor Verordnung dieser Substanzen aufklären.
Treten diese Veränderungen unter neuroleptischer Medikation auf, sollte man unbedingt einen Wechsel des Präparates versuchen. Für Clozapin gilt, dass dies aufgrund seiner Nebenwirkungen (Gefahr einer Agranulozytose, Gewichtszunahme, Speichelfluß, Müdigkeit) trotz seiner besondres guten Wirksamkeit erst dann eingesetzt wird, wenn alle anderen Neuroleptika keine ausreichende Wirkung gezeigt haben. So kann man für viele Patienten diese Nebenwirkung vermeiden.
Bei Olanzapin und den anderen Atypika hat es sich bewährt, bei einer Gewichtszunahme von mehr als 3 Kilogramm in den ersten sechs Wochen nach Beginn der Behandlung einen Wechsel des Präparates vorzuschlagen. Darüber hinaus sollte man einen gesunden Lebensstil besprechen, also insbesondere genügend körperliche Aktivität, gesunde Ernährung und die Beibehaltung eines normalen Gewichtes; zunächst steht also in der Regel eine Diät an. Liegt ein Diabetes mellitus vor, sollte er bei nicht ausreichender Wirkung der Ernährungs- und Bewegungstherapie medikamentös behandelt werden. Gleiches gilt für die Einstellung des Bluthochdrucks.
In der ICD-10 kann man das metabolische Syndrom nur hilfsweise mit dem Code E.88.9 „Stoffwechselstörung, nicht näher bezeichnet“ kodieren.