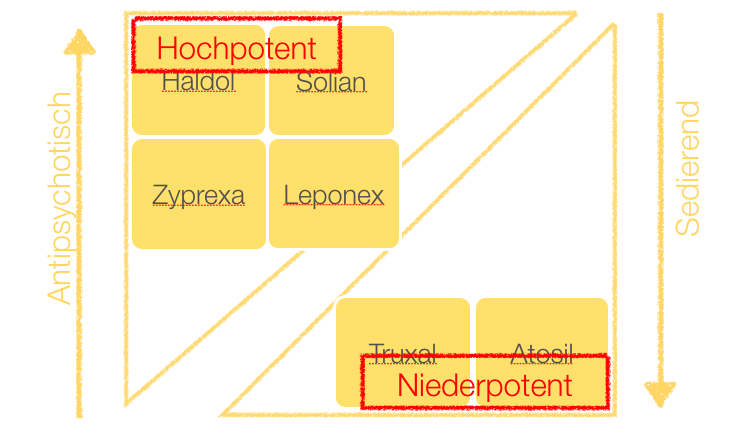
In diesem Video beschreibe ich, welche Nebenwirkungen unter Neuroleptika häufig vorkommen. Ich beginne mit einem Fallbeispiel, dass zeigt, dass Neuroleptika gut gegen Psychosen wirken, aber oft aufgrund von Nebenwirkungen abgesetzt werden. Ich erkläre die Einteilung der Neuroleptika in niedrigpotente Neuroleptika und hochpotente Neuroleptika. Hochpotente Neuroleptika sollte man besser Antipsychotika nennen, da sie die psychotische Symptome gut behandeln können. Die hochpotenten Antipsychotika werden noch einmal in typische und atypische Neuroleptika unterteilt. Ich erkläre dann die vier wichtigsten dopaminergen Bahnen im Gehirn. Bei der Therapie mit Neuroleptika werden diese Bahnen in ihrer Aktivität gebremst.
Dies führt zu typischen Nebenwirkungen:
Das Mesolimbische System
- Dies ist das System, das wohl bei der Psychose am ehesten überhitzt ist. Beim Gesunden ist es für Freude, Lust und Motivation da. Wenn in diesem System Dopamin ausgeschüttet wird, dann weiß der Mensch: Hier passiert gleich etwas Wichtiges, hier lohnt es sich, aufzupassen und dranzubleiben.
- Wenn man dieses System mit Antipsychotika zu stark drosselt, ergeben sich daraus oft Lustlosigkeit und Interessenverlust.
Das Nigrostriatale System
- Dieses System ist beim Gesunden für Bewegungen zuständig.
- Eine bekannte Krankheit, bei der zu wenig Dopamin in diesem System zur Verfügung steht, ist der M. Parkinson.
- Die gleichen Beschwerden wie beim Parkinson treten auf, wenn antipsychotische Medikamente das nigrostriatale System zu stark drosseln, es entsteht ein medikamentös verursachter Parkinsonismus. Die Patienten gehen mit steifen Armen und Beinen, man sagt „wie ein Teddybär“, sie zittern, die Mimik ist reduziert und spontane Bewegungen fallen schwer.
Das Mesocortikale System
- Ist beim Gesunden für Denken, Gefühle und Motivation zuständig.
- Wird es durch Antipsychotika zu stark gedämpft, können Antriebslosigkeit und Affektverflachung entstehen. Die Patienten „kommen einfach nicht mehr aus dem Quark“ und verlieren das Interesse an allem. Nichts macht mehr richtig Spaß und daher scheint es sich für nichts mehr zu lohnen, sich aufzuraffen.
Das Tuberoinfundibuläre System
- Regelt beim Gesunden die Freisetzung des Hormons Prolactin. Das Hormon Prolactin führt zur Milchproduktion in den Brustdrüsen. Dies ist bei Frauen in der Stillzeit ja auch sinnvoll.
- Dopamin ist das „Prolactin inhibitin factor“ eine Dopaminblockade durch Antipsychotika führt also zu einer Überproduktion von Prolactin, einer Hyperprolactinämie.
- Wenn zu viel Prolactin im Blut ist kommt es bei Frauen und Männern zu einem Milchfluß. Es fließt also sowohl bei Frauen als auch bei Männern aus den bei Männern ja auch angelegten Brustdrüsen Milch. Darüber hinaus kann es durch einen zu hohen Prolactinspiegel zu sexuellen Funktionsstörungen kommen.
Dann gehe ich kurz auf einige spezifische Nebenwirkungen bestimmter Neuroleptika ein, wie z.B. QTc-Zeit-Verlängerungen, das metabolische Syndrom oder die Agranulozytose. Schließlich nenne ich einige Vorgehensweisen, die helfen können, Nebenwirkungen zu verhindern und spreche darüber, was man tun kann, wenn dennoch Nebenwirkungen aufgetreten sind.
Quellen
https://commons.wikimedia.org/wiki/File:Dopaminergic_pathways.svg
Wem meine Grafik gefällt, der darf sie gerne weiterverwenden: