Quetiapin
Mein neues Video Eine ehrliche Aufklärung über Neuroleptika ist online
In diesem Video beschreibe ich, welche Nebenwirkungen unter Neuroleptika häufig vorkommen. Ich beginne mit einem Fallbeispiel, dass zeigt, dass Neuroleptika gut gegen Psychosen wirken, aber oft aufgrund von Nebenwirkungen abgesetzt werden. Ich erkläre die Einteilung der Neuroleptika in niedrigpotente Neuroleptika und hochpotente Neuroleptika. Hochpotente Neuroleptika sollte man besser Antipsychotika nennen, da sie die psychotische Symptome gut behandeln können. Die hochpotenten Antipsychotika werden noch einmal in typische und atypische Neuroleptika unterteilt. Ich erkläre dann die vier wichtigsten dopaminergen Bahnen im Gehirn. Bei der Therapie mit Neuroleptika werden diese Bahnen in ihrer Aktivität gebremst.
Dies führt zu typischen Nebenwirkungen:
Das Mesolimbische System
- Dies ist das System, das wohl bei der Psychose am ehesten überhitzt ist. Beim Gesunden ist es für Freude, Lust und Motivation da. Wenn in diesem System Dopamin ausgeschüttet wird, dann weiß der Mensch: Hier passiert gleich etwas Wichtiges, hier lohnt es sich, aufzupassen und dranzubleiben.
- Wenn man dieses System mit Antipsychotika zu stark drosselt, ergeben sich daraus oft Lustlosigkeit und Interessenverlust.
Das Nigrostriatale System
- Dieses System ist beim Gesunden für Bewegungen zuständig.
- Eine bekannte Krankheit, bei der zu wenig Dopamin in diesem System zur Verfügung steht, ist der M. Parkinson.
- Die gleichen Beschwerden wie beim Parkinson treten auf, wenn antipsychotische Medikamente das nigrostriatale System zu stark drosseln, es entsteht ein medikamentös verursachter Parkinsonismus. Die Patienten gehen mit steifen Armen und Beinen, man sagt „wie ein Teddybär“, sie zittern, die Mimik ist reduziert und spontane Bewegungen fallen schwer.
Das Mesocortikale System
- Ist beim Gesunden für Denken, Gefühle und Motivation zuständig.
- Wird es durch Antipsychotika zu stark gedämpft, können Antriebslosigkeit und Affektverflachung entstehen. Die Patienten „kommen einfach nicht mehr aus dem Quark“ und verlieren das Interesse an allem. Nichts macht mehr richtig Spaß und daher scheint es sich für nichts mehr zu lohnen, sich aufzuraffen.
Das Tuberoinfundibuläre System
- Regelt beim Gesunden die Freisetzung des Hormons Prolactin. Das Hormon Prolactin führt zur Milchproduktion in den Brustdrüsen. Dies ist bei Frauen in der Stillzeit ja auch sinnvoll.
- Dopamin ist das „Prolactin inhibitin factor“ eine Dopaminblockade durch Antipsychotika führt also zu einer Überproduktion von Prolactin, einer Hyperprolactinämie.
- Wenn zu viel Prolactin im Blut ist kommt es bei Frauen und Männern zu einem Milchfluß. Es fließt also sowohl bei Frauen als auch bei Männern aus den bei Männern ja auch angelegten Brustdrüsen Milch. Darüber hinaus kann es durch einen zu hohen Prolactinspiegel zu sexuellen Funktionsstörungen kommen.
Dann gehe ich kurz auf einige spezifische Nebenwirkungen bestimmter Neuroleptika ein, wie z.B. QTc-Zeit-Verlängerungen, das metabolische Syndrom oder die Agranulozytose. Schließlich nenne ich einige Vorgehensweisen, die helfen können, Nebenwirkungen zu verhindern und spreche darüber, was man tun kann, wenn dennoch Nebenwirkungen aufgetreten sind.
Quellen
https://commons.wikimedia.org/wiki/File:Dopaminergic_pathways.svg
Wem meine Grafik gefällt, der darf sie gerne weiterverwenden:

Vereinfachte Nebenwirkungsprofile ausgewählter Antipsychotika

Ich habe mich – aus Gründen – hier mal an einer Grafik versucht, die das Nebenwirkungsprofil ausgewählter Antipsychotika vereinfachend aber übersichtlich darstellt. Die Kunst bei dieser Grafik läge darin, zu vermitteln, wo der Hase bei jedem einzelnen Medikament im Pfeffer liegt, wohl wissend, dass dies alles eine Vereinfachung ist.
Wie sieht die Grafik für euch aus? Kann man damit was anfangen? Ist das ganze Konzept zu vereinfachend? Muss ein bestimmtes Medikament in eine Richtung verrückt werden?
Schreibt mir eure Ideen dazu gerne in die Kommentare! #followerpower
Wie rechne ich die Dosis eines Neuroleptikums auf ein anderes um?
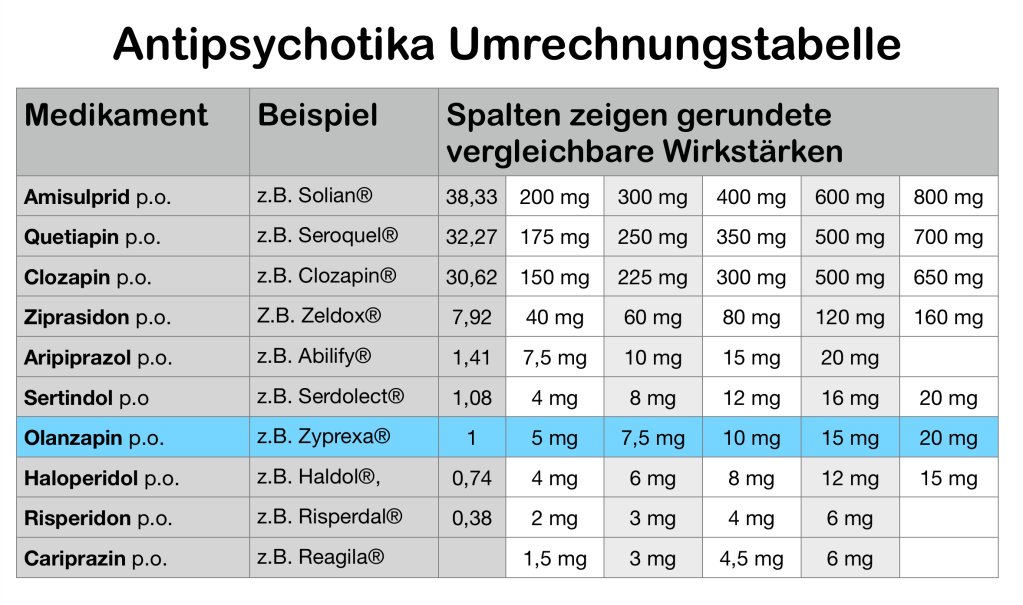
Wenn man ein Medikament aus einer bestimmten Gruppe auf ein anderes Medikament aus derselben Gruppe umstellen möchte, dann ist es ganz hilfreich, eine Vorstellung davon zu haben, welche Dosierungen sich in etwa entsprechen. Natürlich kann man die Dosierungen nicht einfach umrechnen, denn jede Substanz hat doch etwas andere Hauptwirkungen und oft erheblich unterschiedliche Nebenwirkungen. Dennoch ist es hilfreich, einen Anhaltspunkt zu haben, in welcher Größenordnung sich die neue Dosis so bewegt.
Es gibt verschiedene Arten, an so eine Umrechnungstabelle zu kommen. Die klassische Variante ist die von Davis 1974 angewendete: Man nimmt sich alle verfügbaren Studien zu Medikamenten einer Gruppe, in der die Studienärzte nicht wussten, welches Medikament sie gaben, aber die Dosis nach der klinischen Wirkstärke anpassen konnten. Dann nimmt man den Mittelwert der jeweils gegebenen Dosierungen und geht davon aus, dass diese Mittelwerte vergleichbar sind. In einer ausgezeichneten Arbeit hat Leucht dieses Vorgehen 2015 für atypische Antipsychotika durchgeführt1. Das PDF der Studie ist kostenlos hier zu laden.
Cariprazin wurde in dieser Studie nicht untersucht. Die Äquivalenzwerte für Cariprazin habe ich daher aus meiner eigenen klinischen Erfahrung geschätzt und mich an dieser Studie2 angelehnt.
Ich habe auf diesem Blog bereits meine eigene Umrechnungstabelle für Opiate und meine eigene Umrechnungstabelle für Antidepressiva veröffentlicht. Das Bild oben zeigt die Tabelle, die sich aus der Studie von Leucht für die Gruppe der Antipsychotika ergeben. Ich habe deutsche Handelsnamen eingesetzt, die resultierenden Dosierungen auf für die nächste für dieses Präparat übliche Dosis gerundet und diejenigen Tabellenfelder leer gelassen, die Dosierungen enthalten hätten, die für dieses Präparat in Deutschland nicht zugelassen sind.
Wer sich ein eigenes Bild über meine Rundungen und Vereinfachungen machen möchte, der findet die Tabelle mit den präzise berechneten Werten, die ich als Ausgangswerte für die Tabelle oben genommen habe, hier:
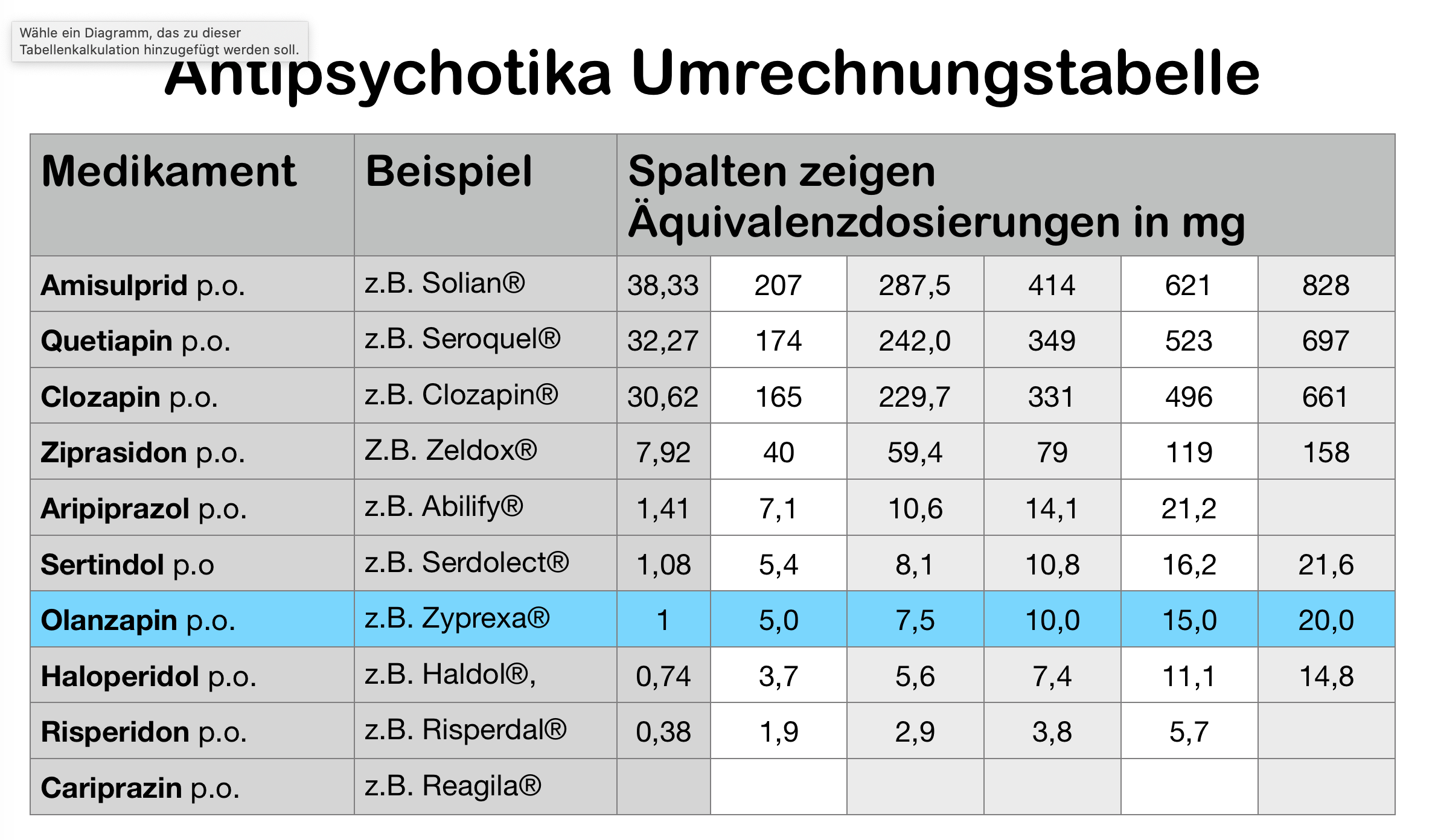
Meiner persönlichen Einschätzung nach ist die Tabelle oben realistisch und gut geeignet, einen Anhaltspunkt dafür zu geben, welche Dosis eines Antipsychotikums welcher Dosis eines anderen Antipsychotikums entspricht.
Disclaimer
Auch zu dieser Tabelle möchte ich sagen, dass die hier angegebenen Dosierungen nicht ungeprüft übernommen werden dürfen. Die Verschreibung obliegt der Verantwortung des verschreibenden Arztes, der anhand der Fachinformationen, der individuellen Situation des Patienten und aller anderen relevanten Faktoren eine Wahl treffen muss.
Copyright
Dieser Beitrag ist ein Auszug beziehungsweise eine auszugsweise Vorabveröffentlichung des Werks „Psychopharmakotherapie griffbereit“ von Dr. Jan Dreher, © Georg Thieme Verlag KG. Die ausschließlichen Nutzungsrechte liegen beim Verlag. Bitte wenden Sie sich an permissions@thieme.de, sofern Sie den Beitrag weiterverwenden möchten.
- 1 Leucht S, Samara M, Heres S, Patel MX, Furukawa T, Cipriani A, Geddes J, Davis JM. Dose Equivalents for Second-Generation Antipsychotic Drugs: The Classical Mean Dose Method. Schizophr Bull 2015; 41: 1397–1402 Im Internet: https://academic.oup.com/schizophreniabulletin/article/41/6/1397/2526028 ↩︎
- 1 Németh G, Laszlovszky I, Czobor P, Szalai E, Szatmári B, Harsányi J, Barabássy Á, Debelle M, Durgam S, Bitter I, Marder S, Fleischhacker WW. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017; 389: 1103–1113 Im Internet: https://linkinghub.elsevier.com/retrieve/pii/S0140673617300600 ↩︎
Die Rezeptorbindungsprofile der Neuroleptika
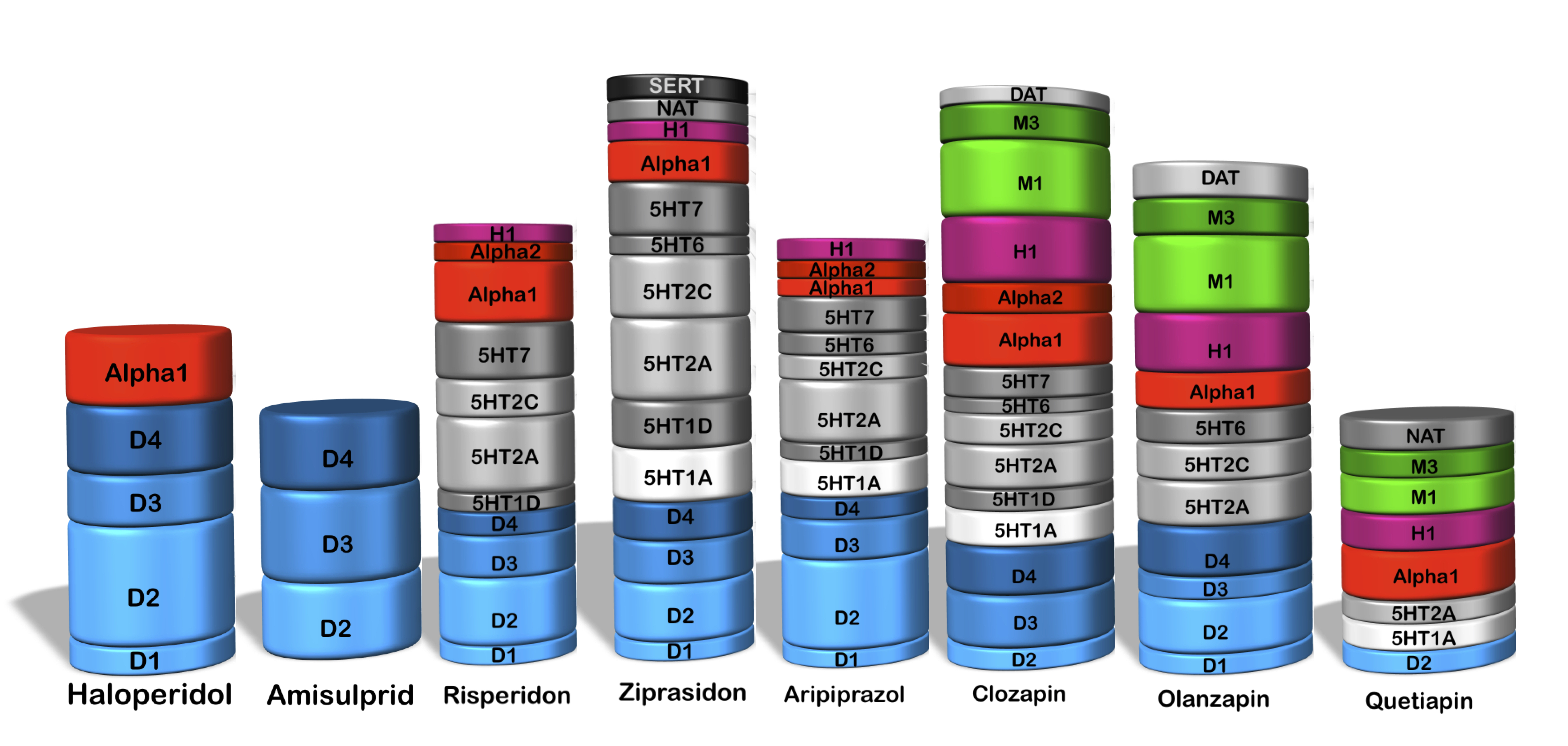
Rezeptorbindungsprofile sind so etwa wie das „Persönlichkeitsprofil“ der Medikamente. Sie bestimmen im Wesentlichen die Wirkungen sowie die unerwünschten Wirkungen jedes einzelnen Medikamentes.
Das Rezeptorbindungsprofil eines Neuroleptikums sagt aus, wie stark dieses Medikament an welche Rezeptoren bindet; welche Affinität es zu den jeweiligen Rezeptortypen hat. Daraus kann man sich die pharmakologischen und klinischen Eigenschaften des Medikamentes im Wesentlichen erschließen. Die folgende Tabelle zeigt wichtige rezeptorblockadebedingte Wirkungen:

(Modifiziert nach Hiemke und Stahl, 2013)
Es gibt darüber hinaus noch vereinzelt weitere Nebenwirkungen, die sich nicht aus der Blockade eines Rezeptors erklären. Ein Beispiel hierfür ist die blutbildschädigende Wirkung des Clozapins, die eine allergische Reaktion ist.
Wenn man sich selbst ein Bild davon machen möchte, was man von einem Medikament zu erwarten hat, sind die Rezeptorbindungsprofile sicherlich der beste Einstieg. Die Übersichtsgrafik zeigt die häufigsten Neuroleptika sowie zum Vergleich das alte Chlorpromazin. Die Grafiken sind so zu lesen, dass die „Dicke“ einer Scheibe anzeigt, wie stark das Medikament den entsprechenden Rezeptor blockiert. Bewirkt ein Medikament an einem bestimmten Rezeptor keine Blockade, ist keine entsprechende Scheibe eingezeichnet. Bei den einzelnen Substanzen sind die typischen Wirkungen und Nebenwirkungen der jeweiligen Rezeptorblockade als Textanmerkung gleich mit eingezeichnet.
Die blauen Blöcke stehen für die Dopaminrezeptoren D1-D4. Die grauen Blöcke stehen für die Serotoninrezeptoren 5HT1-7, wobei der erste Block für einen 5HT1A-Partialagonismus steht. Alpha1 und Alpha2 repräsentieren die Alpha 1 und Alpha 2-Adrenorezeptoren. Es folgen der H1=Histamin-H1 und die M1/M3=muskarinischen Acetylcholinrezeptoren. DAT ist der Dopamin-Transporter, NAT der Noradrenalin-Transporter und SERT der Serotonin-Transporter.
Vorstellung der wichtigsten Neuroleptika mit ihrem jeweiligen Rezeptorbindungsprofil
Haloperidol

Haloperidol ist der Klassiker eines typischen Neuroleptikums. Es blockiert stark die Dopamin-D2-Rezeptoren, was zu einer sicheren antipsychotischen Wirkung, aber in höheren Dosierungen auch zu EPMS und Hyperprolaktinämie führt. Ein Teil der vegetativen Nebenwirkungen und ein Teil der Sedierung sind auf die Blockade der Alpha-1-Adrenozeptoren zurückzuführen.
Amisulprid

Amisulprid ist ein lupenreiner Dopamin-Rezeptor-Antagonist. Das erklärt seine gute antipsychotische Wirkung. In höheren Dosierungen verursacht es EPMS und Hyperprolaktinämie. Es hat praktisch keine sedierenden oder anderen vegetativen Nebenwirkungen, da es praktisch keine anderen Rezeptoren blockiert.
Risperidon

Risperidon blockiert zum einen wie ein typisches Neuroleptikum in relevantem Ausmaß die Dopamin-D2-Rezeptoren, und zum anderen wie viele atypische Neuroleptika den Serotonin-5HT2A-Rezeptor. Es verursacht nur in geringem Maße Gewichtszunahme und Müdigkeit, entsprechend seiner nur geringen, aber vorhandenen Aktivität am Histamin H1-Rezeptor.
Ziprasidon

Ziprasidon entspricht ganz dem Profil eines atypischen Neuroleptikums. Es blockiert zwar auch den D2-Rezeptor, hat seinen Schwerpunkt aber eher auf 5HT2A. Interessant ist die Noradrenalin- und Serotonin-Wiederaufnahmehemmung, die eine milde antidepressive und angstlösende Wirkung plausibel macht.
Aripiprazol

Im Falle des Aripiprazols muss man wissen, das die Affinität dieses Medikamentes zum Dopamin-D2-Rezeptor nicht nur antagonistische, sondern auch partiell agonistische Wirkungen hat. Dies relativiert einige der D2-bezogenen Nebenwirkungen, so verursacht Aripiprazol tatsächlich weniger EPMS, als dem Ausmaß der D2-Affinität in diesem Schaubild entsprechen würde. Man erhofft sich vom partiellen Dopamin-D2-Agonismus auch eine positive Wirkung auf Antrieb, Stimmung und kognitive Fähigkeiten.
Clozapin

Clozapin hat ein ganz spezielles Rezeptorbindungsprofil. Der hohe Anteil der Dopamin-D4-Blockade wird mit seiner guten antipsychotischen Wirkung bei wenig EPMS in Verbindung gebracht. Und die Affinität von Clozapin zu den Dopamin-D2-Rezeptoren ist ja vergleichsweise niedrig. Betrachtet man jedoch den oberen Teil der Grafik, weiß man, warum Clozapin so ausgeprägte Nebenwirkungen verursacht. Insbesondere Müdigkeit und Gewichtszunahme (H1) wirken sich klinisch stark aus. Der erhöhte Speichelfluß unter Clozapin ist auf eine reduzierte Schluckfähigkeit zurück zu führen; die durch die Blockade des Acetylcholin-M1-Rezeptors verursachte Mundtrockenheit wiegt diese Schluckstörung nicht auf.
Olanzapin

Olanzapin hat aus der Sicht des Rezeptorbindungsprofils viel Ähnlichkeit mit Clozapin. Interessant ist auch hier, dass Dopamin-D4-Rezeptoren fast so stark blockiert werden wie Dopamin-D2-Rezeptoren, was für eine gute antipsychotische Wirkung bei wenig EPMS spricht. Allerdings blockiert Olanzapin ebenfall stark den Histamin-H1-Rezeptor, was die Sedierung und Gewichtszunahme erklärt.
Quetiapin

Der Blick auf das Rezeptorbindungsprofil von Quetiapin zeigt ein solides mittelpotentes Neuroleptikum mit einer recht ausgeprägten Sedierung (Alpha1, H1, M1, M3) und einer milden antipsychotischen Wirkung (D2, 5HT2A).
Copyright
Ihr dürft diese Darstellungen gerne unter Nennung der Quelle http://www.psychiatrietogo.de weiterverwenden und auch weiter verbessern. Dann schickt mir doch gerne einen Link auf eure Version. Ich bin gespannt auf eure Kommentare!
Meine neue Darstellung der Rezeptorbindungsprofile

Ich habe auf dem diesjährigen DGPPN-Kongress zum wiederholten Mal den Workshop „Psychopharmakologie-Update“ von Francesca Regen, Arnim Quante und Eric Hahn besucht. Die drei berichten sehr kompetent und zugleich sehr verständlich von den nennenswerten Neuerungen im letzten Jahr.
Noch eine Variante: Das klassische Kreisdiagramm

Üblicherweise stellt man die Rezeptorbindungsprofile so dar, wie in dem oben wiedergegebenen Kreisdiagramm zu Risperidon. Diese Abbildung ist aus meinem Buch Psychopharmakotherapie griffbereit, Dritte Auflage, entnommen. Die Darstellung ist übersichtlich, aber interpretationsbedürftig.
Wie interpretiere ich das Rezeptorprofil eines Neuroleptikums?
Ich hatte in diesem post schon einmal die wesentlichen Wirkungen der Blockade (oder partiellen Aktivierung) bestimmter Rezeptoren dargestellt.
Die Darstellung á la Hiemke gefällt mir besonders gut, da ich mir das Medikament in dieser Darstellung wie einen Schlüssel vorstelle. Die Balken darauf entsprechen den Zacken des Bartes des Schlüssels. Man hat ja immer die Analogie im Kopf, dass sich ein Wirkstoff zum Rezeptor wie ein Schlüssel zum Schloss verhält. Das stimmt auch für die primären Wirkstoffe wie Dopamin oder Serotonin. Wobei man im Kopf behalten muss, dass diese Wirkstoffe die Rezeptoren aktivieren, die Medikamente die Rezeptoren aber in der Regel blockieren. Ausnahmen stellen Medikamente wie Aripiprazol dar, die überwiegend Rezeptoren blockieren, einige wenige Rezeptoren aber partiell aktivieren.
Neuer Ansatz: Rezeptoraktivität und deren Wirkungen in einem Schaubild
Nun habe ich mir überlegt, dass es etwas mühsam ist, die Rezeptoraktivität in einem Diagramm darzustellen und die Wirkung, also die erwünschten Wirkungen und die unerwünschten Wirkungen dieser Aktivität am Rezeptor, in einer zweiten Tabelle nachzulesen. Daher habe ich in meiner neuen Darstellung die jeweilige Rezeptoraktivität mit der erklärenden Tabelle überlagert. Die Darstellungen sind so zu lesen, dass die Länge des farbigen Balkens die Aktivität des jeweiligen Medikamentes an diesem Rezeptor wiedergibt. Wenn ein Medikament einen bestimmten Rezeptor gar nicht blockiert, dann ist der Text daneben entsprechend ausgegraut.
Vorstellung der wichtigsten Neuroleptika mit ihrem jeweiligen Rezeptorbindungsprofil
Haloperidol

Haloperidol ist der Klassiker eines typischen Neuroleptikums. Es blockiert stark die Dopamin-D2-Rezeptoren, was zu einer sicheren antipsychotischen Wirkung, aber in höheren Dosierungen auch zu EPMS und Hyperprolaktinämie führt. Ein Teil der vegetativen Nebenwirkungen und ein Teil der Sedierung sind auf die Blockade der Alpha-1-Adrenozeptoren zurückzuführen.
Amisulprid

Amisulprid ist ein lupenreiner Dopamin—Rezeptor-Antagonist. Das erklärt seine gute antipsychotische Wirkung. In höheren Dosierungen verursacht es EPMS und Hyperprolaktinämie. Es hat praktisch keine sedierenden oder anderen vegetativen Nebenwirkungen, was der Abwesenheit von Rezeptorblockaden anderer Rezeptoren entspricht.
Risperidon

Risperidon blockiert zum einen wie ein typisches Neuroleptikum in relevantem Ausmaß die Dopamin-D2-Rezeptoren, und blockiert zum anderen wie viele atypische Neuroleptika den Serotonin-5HT2A-Rezeptor. Es verursacht nur in geringem Maße Gewichtszunahme und Müdigkeit, entsprechend seiner nur geringen, aber vorhandenen Aktivität am Histamin H1-Rezeptor.
Ziprasidon

Ziprasidon entspricht ganz dem Profil eines atypischen Neuroleptikums. Es blockiert zwar auch den D2-Rezeptor, hat seinen Schwerpunkt aber eher auf 5HT2A. Interessant ist die Noradrenalin- und Serotonin-Wiederaufnahmehemmung, die eine milde antidepressive und angstlösende Wirkung plausibel macht.
Aripiprazol

Diese Darstellung ist für Aripiprazol eigentlich ungeeignet, da Aripiprazol am Dopamin-D2-Rezeptor sowohl antagonistische Wirkungen hat (das ist auch dargestellt), als auch partiell agonistisch am Dopamin-D2-Rezeptor wirkt (das ist hier nicht dargestellt). Diese partialagonistische Wirkung an D2 relativiert einige der Nebenwirkungen und natürlich auch einige der Wirkungen des Medikamentes an diesem Rezeptor. Und das auch noch dosisabhängig. OK, die Darstellung ist natürlich eine Vereinfachung. Im übrigen zeigt sich das Profil eines atypischen Neuroleptikums mit milden Nebenwirkungen.
Chlorpromazin

Chlorpromazin wird in Deutschland praktisch nicht mehr verordnet. Es ist ein mittelpotentes Neuroleptikum mit eher sedierenden Eigenschaften. Ein Nischendasein führt es noch in der Behandlung des chronischen Schluckaufs…
Clozapin

Clozapin ist zwar ein Oldtimer, hat aber ein ganz spezielles Rezeptorbindungsprofil. Der hohe Anteil der Dopamin-D4-Blockade wird allgemein mit seiner guten antipsychotischen Wirkung bei wenig EPMS in Verbindung gebracht. Und D2-Rezeptoren läßt Clozapin ja ziemlich in Ruhe. Sieht man sich aber den unteren Teil der Grafik an, weiß man auch, warum es so ausgeprägte Nebenwirkungen verursacht. Insbesondere Müdigkeit und Gewichtszunahme (H1) wirken sich klinisch stark aus. Der erhöhte Speichelfluß unter Clozapin ist ursächlich auf eine reduzierte Schluckfähigkeit zurück zu führen. Die durch die Blockade des Acetylcholin-M1-Rezeptors verursachte Mundtrockenheit wiegt die Schluckstörung nicht auf.
Olanzapin

Olanzapin hat aus der Sicht des Rezeptorbindungsprofils viel Ähnlichkeit mit Clozapin. Interessant ist auch hier, dass D4-Rezeptoren fast so stark blockiert werden wie D2-Rezeptoren, was für eine gute antipsychotische Wirkung bei wenig EPMS spricht. Allerdings blockiert Olanzapin eben auch stark den Histamin-H1-Rezeptor, was die Sedierung und Gewichtszunahme erklärt.
Quetiapin

Quetiapin wurde ja lange als neuroleptisches Wundermittel vermarktet. Der Blick auf das Rezeptorbindungsprofil zeigt ein solides mittelpotentes Neuroleptikum mit einer recht ausgeprägten Sedierung (Alpha1, H1, M1, M3) und einer milden antipsychotischen Wirkung (D2, 5HT2A).
Bitte um Feedback
Ich selbst bin ein großer Freund des Studiums des Rezeptorbindungsverhaltens der Medikamente. In meinen Augen entsprechen die neuroleptische Wirkstärke, das typische / atypische Wirkprofil und auch die Nebenwirkungen, die man in der Praxis beobachtet, ziemlich genau diesen Profilen.
Nun bitte ich euch um euer Feedback!
- Wie verständlich ist diese Art der Darstellung?
- Gibt es falsche oder unklare Beschreibungen im Text der Tabelle?
- Was könnte man verbessern, um die Darstellung noch eingängiger zu gestalten?
Ihr dürft die Darstellung gerne unter Nennung der Quelle weiterverwenden und auch weiter verbessern. Dann schickt mir doch gerne einen Link auf eure Darstellung. Ich bin gespannt auf eure Kommentare!
Das Patent für Quetiapin ist nun abgelaufen
Zum 25.03.2012 ist das Patent für Quetiapin abgelaufen. Dies gilt nur für die unretardierte Darreichungsform, Seroquel Prolong ist noch patentgeschützt. Zahlreiche Generikahersteller bieten nun Quetiapin an, die Preise bewegen sich bereits nach unten. Die 25 mg Tablette ist bei Hexal 75 % billiger als das Original, die höheren Dosierungen sind gegenwärtig auch bei den Generikaherstellern noch recht teuer, aber der Wettbewerb wird´s schon richten…
Gegenwärtig kostet eine Original-Packung Seroquel 200 mg mit 100 Tabletten 363 €; der billigste Generikahersteller nimmt im Moment pro 100 Stück 200 mg 87,95 € (TAD mit Quentiax). (Danke für den Hinweis im Kommentar, Apotheker30!)
Auch Galantamin (Erstanbieter: Reminyl) ist jetzt patentfrei…
Welches Neuroleptikum gebe ich wem?
Nehmen wir an, in meine Behandlung kommt ein sonst gesunder Patient mit einer Psychose. Ich entscheide mich, dass er ein Neuroleptikum braucht. Das bespreche ich mit ihm und er stimmt dem auch zu. Nun stellt sich die Frage: Welches Neuroleptikum empfehle beziehungsweise verordne ich? Es gibt keine ganz einfache Faustformel, nach der ich für einen bestimmten Patienten ein Neuroleptikum auswähle, aber ich habe ein bestimmtes Vorgehen, dass ich in bestimmten Fällen anwende. Ich habe hier mal versucht, dies aufzuschreiben:
Welches Neuroleptikum gebe ich wem?
Konstellation 1: Der erfolgreich vorbehandelte Patient: Auf meine Frage: „Haben Sie schon einmal in einer früheren Krankheitsphase ein Neuroleptikum erhalten? Hat es gut gewirkt und haben Sie es gut vertragen?“ antwortet er zwei mal mit „Ja“, d.h. ein bestimmtes Präparat hat schon einmal gut gewirkt und wurde gut vertragen. Dann empfehle ich genau dieses Medikament wieder. Ich frage, welche Symptomatik damals bestanden hat und wie stark sie war und welche Dosis des Präparates in welcher Zeit geholfen hat. Ich mache mir ein Bild davon, wie stark die Symptomatik jetzt ist und empfehle eine passende Dosis.
Konstellation 2: Der bislang unbehandelte Patient: Wenn bislang noch nie ein Neuroleptikum verordnet wurde empfehle ich in der Regel in der ersten Stufe Risperidon. Es wirkt schnell und verläßlich. Es macht nicht müde und es macht keine Gewichtszunahme. Wenn ich selbst ein Neuroleptikum bräuchte, würde ich mich auch für Risperidon entscheiden. (Das stimmt sogar mit dem Ergebnis meiner kleinen Umfrage überein: Welches Neuroleptikum würdest Du selbst einnehmen: hier). In Dosierungen bis 4 mg pro Tag ist es meist gut verträglich und macht meist keine EPMS. In höheren Dosierungen kann es EPMS machen.
Konstellation 3: Risperdal hat nicht ausreichend geholfen oder wurde nicht vertragen. Der Pat. ist nicht adipös: In der zweiten Stufe empfehle ich in der Regel Zyprexa (nachdem ich über die Möglichkeit einer Gewichtszunahme aufgeklärt habe). Es wirkt ebenso sicher, verläßlich und zügig wie Risperidon und wird ebenfalls zumeist gut vertragen. Es kann aber tatsächlich eine deutliche Gewichtszunahme verursachen. Daher lasse ich das Gewicht bei Beginn der Behandlung mit Zyprexa messen. Treten Heißhungerattacken oder eine Gewichtszunahme von mehr als 3 Kilogramm auf, empfehle ich, das Präparat zu wechseln.
Konstellation 4: Zyprexa hat nicht ausreichend geholfen oder wurde nicht vertragen: Wenn Risperdal in Stufe eins wegen mangender Wirksamkeit und nicht wegen EPMS das Feld räumen musste, und in Stufe zwei Zyprexa nicht gut ging, dann versuche ich in der dritten Stufe Solian. Wenn Risperdal EPMS gemacht hatte, dann überspringe ich diesen Schritt.
Konstellation 5: Mit Risperdal, Zyprexa und Solian stellte sich kein Erfolg ein: In der vierten Stufe muss ich ein Neuroleptikum auswählen, dass gegebenenfalls etwas weniger wirkstark ist als Risperdal, Zyprexa und Solian, aber vielleicht besser verträglich ist. Es kommen nun Abilify, Zeldox, Seroquel (meine Einschätzung zu Seroquel findet ihr hier) und Serdolect in Betracht. Ich verordne in dieser Reihenfolge. Abilify führt häufig zu Akathisie, ich setzte es dann zumeist sofort und ohne zu warten ab. Zu Serdolect sind diese Hinweise zu beachten. Zeldox und Seroquel werden in der Regel sehr gut vertragen, hier stellt sich eher die Frage der ausreichenden Wirksamkeit.
Konstellation 6: Eine Monotherapie klappt nicht: In der fünften Stufe wähle ich eine Kombinationstherapie aus zwei Neuroleptika. Geleitet von den Nebenwirkungen der bisherigen Versuche wähle ich gut verträgliche, aber in Monotherapie nicht ausreichend wirksame Präparate aus und gebe beide in einer mittleren Dosis. Dabei unterteile ich die Neuroleptika nach ihren Nebenwirkungen in unterschiedliche Gruppen und meide die Gruppe, deren Nebenwirkung bislang am problematischsten war:
- Gruppe 1: EPMS-Gefahr: Haldol, Solian, Risperdal
- Gruppe 2: Gewichtszunahme-Gefahr: Clozapin, Zyprexa, manchmal Seroquel
- Gruppe 3: Akathisie-Gefahr: Abilify
Konstellation 7: Alle oben genannten Stufen wurden nicht gut vertragen: Ich versuche Serdolect.
Konstellation 8: Alle oben genannten Stufen haben nicht ausreichend gewirkt: Ich kläre ausführlich auf und versuche Clozapin.
Konstellation 9: Reine Rezidivprophylaxe bei asymptomatischem Patienten: Mit großer Sicherheit wirkt das Neuroleptikum, das die psychotische Episode beendet hat. Bei der Rezidivprophylaxe sind aber Nebenwirkungen noch viel weniger akzeptabel als in der Akuttherapie. Bei Nebenwirkungen wechsele ich daher noch niederschwelliger auf ein Ausweichpräparat.
Konstellation 10: Behandlung akuter kokaininduzierter psychotischer Zustände: Kokain ist stark und selektiv dopaminagonistisch. Solian ist stark und selektiv dopaminantagonistisch. Daher behandele ich akute psychotische Zustände nach Kokainkonsum mit Solian.
Konstellation 11: Delir: Ein lebensbedrohliches Delir, egal welcher Genese (Alkoholentzug-, Benzodiazepinentzug-,…) braucht eine wirkstarke und schnelle Neurolepsie. Ich gebe Haloperidol oder Risperidon.
Konstellation 12: Auswahl eines Depotpräparates: Ich mache zunächst einen Versuch mit Fluanxol, zunächst oral gegeben. Wird dies vertragen, gebe ich eine milde Dosis Fluanxol Depot, etwa 40-60 mg alle zwei Wochen. Sind bei dem Patienten unter irgendeiner Medikation EPMS aufgetreten, gebe ich Risperdal Consta oder Xeplion. Immer noch EPMS: Dann Zypadhera. (Zu Depotpräparaten siehe auch hier)
Das ist natürlich nur eine Blaupause, bei jedem einzelnen Patienten können so viele weitere Aspekte eine Rolle spielen, dass diese Blaupause nicht hilft. Aber manchmal hilft sie doch.
OK, das waren jetzt so einige Gedanken, die ich oft anwende. Wie gehst Du vor? Was machst Du anders? Bitte schreib Dein Vorgehen in die Kommentare!
P.S.: Hier der Artikel zur Auswahl eines Antidepressivums.
Copyright
Dieser Beitrag ist ein Auszug beziehungsweise eine auszugsweise Vorabveröffentlichung des Werks „Psychopharmakotherapie griffbereit“ von Dr. Jan Dreher, © Georg Thieme Verlag KG. Die ausschließlichen Nutzungsrechte liegen beim Verlag. Bitte wenden Sie sich an permissions@thieme.de, sofern Sie den Beitrag weiterverwenden möchten.
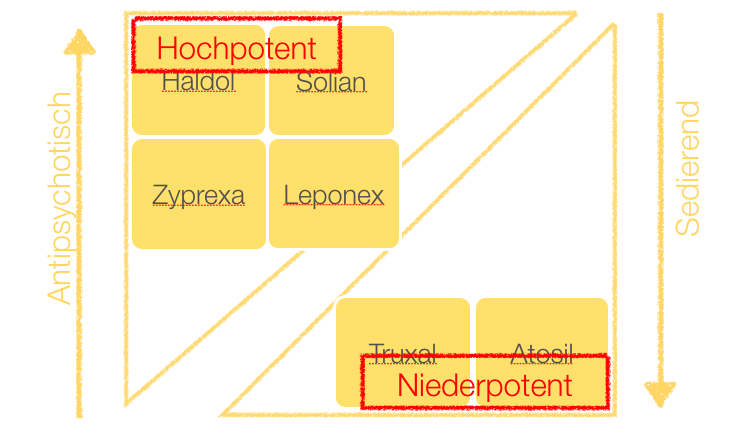
Quetiapin ist ein mittelpotentes Neuroleptikum
Blogs geben ja nun einmal die persönliche Meinung des Blogautors wieder. Nichts anderes. Und das ist auch gut so. Bezüglich des Medikamentes Quetiapin (z. B. Seroquel®) gibt es eine recht breite Streuung der Einschätzungen. Manche halten es für dünne Plörre, die kaum Wirkungen zeigt, manche halten es für ein sehr gut verträgliches Medikament, dass gut gegen Psychosen wirkt, Affekte stabilisiert, phasenprophylaktisch wirkt, antidepressiv wirkt und Läuse tötet.
Nun also meine höchstpersönliche Meinung:
Also: Es gibt ja hochpotente Neuroleptika, wie z.B. Haldol, Risperdal und Zyprexa. Diese Substanzen heißen hochpotent, weil sie sehr potent gegen Wahn und Halluzinationen wirken, aber nur recht wenig sedieren.
Es gibt mittelpotente Neuroleptika, wie das gute alte Taxilan, die sowohl gegen den Wahn wirken, aber eben nicht ganz so durchschlagkräftig wie hochpotente Neuroleptika, und auch sedieren, aber nicht so stark wie die niedrigpotenten Neuroleptika.
Und es gibt die niedrigpotenten Neuroleptika, wie Atosil oder Truxal. Diese wirken fast nicht gegen Wahn und Halluzinationen, sedieren aber sehr gut.
Und wo steht Quetiapin (z.B. Seroquel®)?
In dieser Systematik ordne ich das Quetiapin (=Seroquel) in der Gruppe der mittelpotenten Neuroleptika ein. Es wirkt schon gegen Wahn und Halluzinationen, allerdings meiner Erfahrung nach erst in einer Dosis oberhalb von 600-800 mg pro Tag. Dabei tritt die Wirkung aber langsamer ein und ist bei schwer Kranken weit weniger durchschlagend als bei Risperidon, Haloperidol oder Olanzapin. Es sediert nicht wenig und wird auch oft hierfür verwendet. Die Kombination aus milder Neurolepsie und milder Sedierung ist ja nicht schlecht und wird oft und gerne verschrieben und von sehr vielen Patienten auch gerne eingenommen. Wer noch Erfahrung mit Perazin (z.B. Taxilan) hat, weiß, dass mittelpotente Neuroleptika für viele Patienten eine gute Wahl sind und für einige auch eine ausreichende Rezidivprophylaxe bieten. Allerdings nicht bei allen.
Eingesetzt bei Psychosen sehe ich bei Seroquel häufig das Problem, dass es in sehr niedrigen Dosierungen gegeben wird, in dieser Dosis dann auch sehr gut verträglich und oft als angenehm sedierend eingeschätzt wird, aber nicht ausreichend kräftig rezidivprophylaktisch wirkt. Der Preis kann dann ein mit einer anderen Medikation möglicherweise nicht aufgetretenes Rezidiv sein. Und das wäre ein hoher Preis.
Einen festen Platz hat Seroquel in der Gerontopsychiatrie und bei der Behandlung von psychotischen Symptomen bei M. Parkinson, da es tatsächlich praktisch nie EPMS macht. Als mittelpotentes Neuroleptikum finde ich es gut und gut verträglich, aber sehr teuer. Ich selbst glaube nicht an die beworbene Qualität als Phasenprophylaktikum, Affektstabilisierer oder Antidepressivum.
Das Patent für die unretardierte Form von Seroquel läuft am 24.03.2012 ab. Die Prolong-Form bleibt patentgeschützt. Ich bin gespannt, wie die Verordnungskultur sich durch den fallenden Preis, aber auch die mutmaßlich deutlich reduzierte Bewerbung durch die Firma verändern wird. Sehr erfreulich ist, dass nach Risperidon, Amisulprid und Olanzapin nun bald ein weiteres atypisches Neuroleptikum den Patentschutz verliert und damit preiswerter werden wird.
Ich bin sicher, dass es zu dieser Einschätzung recht viele Meinungen geben wird. Bitte schreibt ALLE Eure Einschätzung von Quetiapin in die Kommentare!
Die Grammy Verleihung der Psychopharmaka 2009
Der Arzneiverordnungsreport 2010 (Schwabe, Paffrath) berichtet über die Verordnungen von Medikamenten im Jahr 2009 durch die niedergelassenen Ärzte der GKV (neuere Daten liegen noch nicht vor…). Hier sind die am häufigsten verschriebenen Psychopharmaka aufgelistet. Die Tabelle gibt zu den genannten Substanzen die Anzahl der verordneten definierten Tagesdosen (defined daily dose, DDD) in Millionen wieder. Die defined daily dose für Citalopram ist beispielsweise mit 20 mg festgelegt. Die Tabelle gibt an, dass von Cipramil 241,7 Millionen Tagesdosen verschrieben worden sind. Legt man zugrunde, dass jeder Patient, der Citalopram erhalten hat, dies das ganze Jahr, also 365 Tage lang erhalten hat, ergibt sich, dass 241,7/365=0,66 Millionen Menschen damit ein Jahr lang behandelt worden wären. Nimmt man an, dass die mittlere Verordnungsdauer 4 Monate betrug, was sehr viel realistischer ist, wären in Deutschland zu Lasten der GKV im Jahre 2009 3*0,66=knapp zwei Millionen Menschen mit Citalopram behandelt worden.
Die ersten 4 Plätze der Tabelle überraschen nicht. Antidepressiva sind die mit Abstand am häufigsten verordneten Psychopharmaka, weil Depressionen und Angsterkrankungen die häufigsten psychischen Erkrankungen sind. Platz 5 und 6 überraschen. Opipramol habe ich daher einen eigenen Artikel gewidmet, zu Metylphenidat will ich noch einen schreiben.
Doch hier nun erst einmal zwei Tabellen, die erste zeigt die Verordnungshäufigkeit, die zweite auszugsweise die Kosten:
| Substanz | Mio. DDD |
| Citalopram | 241,7 |
| Mirtazapin | 123,1 |
| Amitriptylin | 94,5 |
| Venlafaxin | 75,1 |
| Opipramol | 74 |
| Methylphenidat | 55,3 |
| Sertralin | 55,1 |
| Doxepin | 54,2 |
| Escitalopram | 47,5 |
| Zopiclon | 47,3 |
| Fluoxetin | 43,3 |
| Paroxetin | 42,3 |
| Lorazepam | 36,8 |
| Duloxetin | 34,7 |
| Quetiapin | 33,3 |
| Olanzapin | 32,7 |
| Zolpidem | 32,5 |
| Trimipramin | 31,6 |
| Diazepam | 31 |
| Risperidon | 29 |
| Johanniskraut | 27,7 |
| Lithiumsalze | 20,3 |
| Haloperidol | 18,4 |
| Lormetazepam | 15,3 |
| Perazin | 15,2 |
| Oxazepam | 14,1 |
| Clozapin | 13,3 |
Für die Kosten ergibt sich eine ganz andere Tabelle (Auszug, nach Verordnungshäufigkeit sortiert):
| Name | Rang | Verordnungen | Kosten |
| Seroquel | 83 | 1,17 Mio | 259 Mio € |
| Amitriptylin-neurax | 105 | 0,98 Mio. | 18 Mio. € |
| Tavor | 130 | 0,85 Mio. | 12 Mio. € |
| Diazepam-ratiopharm | 154 | 0,76 Mio. | 8 Mio. € |
| Trevilor | 367 | 0,38 Mio. | 69 Mio. € |
Quelle für beide Tabellen: http://www.psywiki.org/index.php?title=Psychopharmaka_Verordnungen_2009